|
|
|
|
|
Глава 8. Основы молекулярно-кинетической теории § 53. Основные положения молекулярно-кинетической теории. Размеры молекулКакие физические объекты (системы) изучает молекулярная физика? Как различить механические и тепловые явления? Приведите примеры тепловых явлений, происходящих в классе, дома, на улице. В основе молекулярно-кинетической теории строения вещества лежат три утверждения:
Каждое утверждение строго доказано с помощью опытов. Свойства и поведение всех без исключения тел определяются движением взаимодействующих друг с другом частиц: молекул, атомов или ещё более малых образований — элементарных частиц.
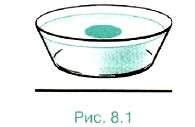
Оценка размеров молекул. Для полной уверенности в существовании молекул надо определить их размеры. Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды. Масло никогда не займёт всю поверхность, если мы возьмём достаточно широкий сосуд (рис. 8.1). Нельзя заставить капельку объёмом 1 мм2 расплыться так, чтобы она заняла площадь поверхности более 0,6 м2. Предположим, что при растекании масла по максимальной площади оно образует слой толщиной всего лишь в одну молекулу — «мономолекулярный слой». Толщину этого слоя нетрудно определить и тем самым оценить размеры молекулы оливкового масла. Объём V слоя масла равен произведению его площади поверхности S на толщину d слоя, т. е. V = Sd. Следовательно, линейный размер молекулы оливкового масла равен:
Современные приборы позволяют увидеть и даже измерить отдельные атомы и молекулы. На рисунке 8.2 показана микрофотография поверхности кремниевой пластины, где бугорки — это отдельные атомы кремния. Подобные изображения впервые научились получать в 1981 г. с помощью сложных туннельных микроскопов. Размеры молекул, в том числе и оливкового масла, больше размеров атомов. Диаметр любого атома примерно равен 10-8 см. Эти размеры так малы, что их трудно себе представить. В таких случаях прибегают к помощи сравнений. Вот одно из них. Если пальцы сжать в кулак и увеличить его до размеров земного шара, то атом при том же увеличении станет размером с кулак. Число молекул. При очень малых размерах молекул число их в любом макроскопическом теле огромно. Подсчитаем примерное число молекул в капле воды массой 1 г и, следовательно, объёмом 1 см3. Диаметр молекулы воды равен примерно 3 • 10-8 см. Считая, что каждая молекула воды при плотной упаковке молекул занимает объём (3 • 10-8 см)3, можно найти число молекул в капле, разделив объём капли (1 см3) на объём, приходящийся на одну молекулу:
Масса молекул. Массы отдельных молекул и атомов очень малы. Мы вычислили, что в 1 г воды содержится 3,7 • 1022 молекул. Следовательно, масса одной молекулы воды (Н20) равна:
Массу такого же порядка имеют молекулы других веществ, исключая огромные молекулы органических веществ; например, белки имеют массу, в сотни тысяч раз большую, чем масса отдельных атомов. Но всё равно их массы в макроскопических масштабах (граммах и килограммах) чрезвычайно малы. Относительная молекулярная масса. Так как массы молекул очень малы, удобно использовать в расчётах не абсолютные значения масс, а относительные.
Относительные атомные массы всех химических элементов точ- но измерены. Складывая относительные атомные массы элементов, входящих в состав молекулы вещества, можно вычислить относительную молекулярную массу вещества. Например, относительная молекулярная масса углекислого газа СO2 приближённо равна 44, так как относительная атомная масса углерода практически равна 12, а кислорода примерно 16 : 12 + 2 • 16 = 44.
|
|
|



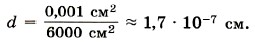
 Обсудите с одноклассником, можно ли доказать первое утверждение, проведя опыт по окрашиванию воды кристалликом марганцовокислого калия? Подумайте, о чём свидетельствует явление распространения запахов ароматических веществ в помещении. Подумайте, как экспериментально доказать, что частицы вещества притягиваются и отталкиваются.
Обсудите с одноклассником, можно ли доказать первое утверждение, проведя опыт по окрашиванию воды кристалликом марганцовокислого калия? Подумайте, о чём свидетельствует явление распространения запахов ароматических веществ в помещении. Подумайте, как экспериментально доказать, что частицы вещества притягиваются и отталкиваются.

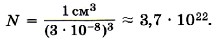
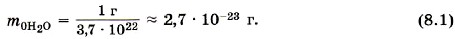
 массы атома углерода (так называемая углеродная шкала атомных масс).
массы атома углерода (так называемая углеродная шкала атомных масс).

 Сравнение атомов и молекул с
Сравнение атомов и молекул с